经过多年的准备和布局,2021年国家药监局正式启动PIC/S预加入申请工作,在今年7月召开药品检查合作计划(PIC/S)工作推进会中,我们可以看到中国加入PIC/S的各项工作正稳步向前推进。加入PIC/S是我国药品监管国际化的一项重要工作,对我国GMP检查标准的提高、检查标准的协调及监管力量加强有较大的推动作用,积极提升我国医药市场国际竞争力等。
01 什么是PIC/S
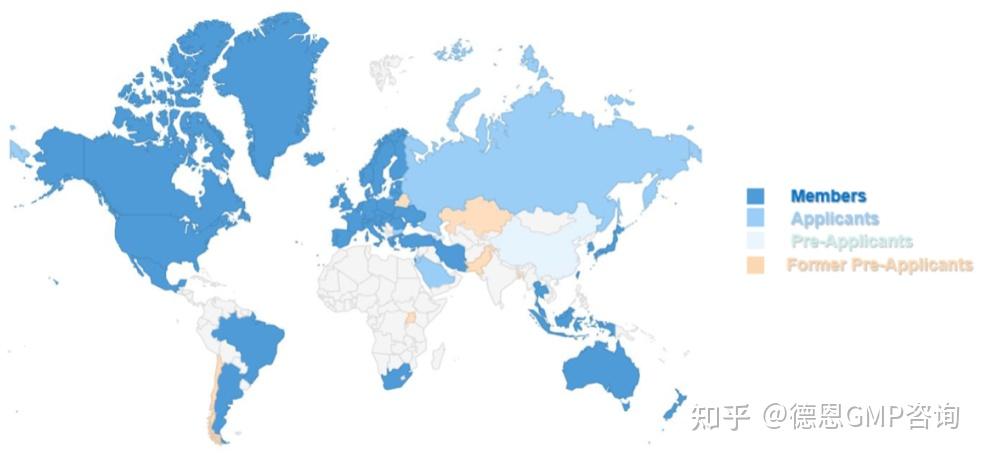
PIC/S是国际药品检查合作计划组织(The Pharmaceutical Inspection Co-operation Scheme)的简称,成立于1995年,它是世界上唯一的由GMP检查执法机关组成的国际合作组织。
PIC/S设有委员会、执行委员会和秘书处三个职能组织,
• 委员会负责对GMP标准进行修改、更新和完善;
• 执行委员会负责委员会的日常工作以及举办会议;
• 秘书处主要协调和实施GMP活动,提供工作推进的资源。
目前,其成员数量有58个,覆盖全球接近50个国家和地区。
02 PIC/S的历史
PIC/S前身为创立于1970年的PIC(欧洲贸易自由联盟成立的药品检查联盟),PIC的组织章程与PIC/S不同,PIC是一个以国家为会员单位共同签署成立的正式国际组织。由于PIC受限于欧盟体制而无法与其它想加入的国家签署协议,因而衍生出另一个非正式、更有灵活性的国际合作组织PIC Scheme。
直到1995年,PIC与PIC Scheme并行运作(合称PIC/S),持续致力于促进GMP的国际合作及检查标准一致性。
03 PIC/S的使命
PIC/S的成立的使命是:
• 通过制定统一的GMP标准和指南文件
• 为GMP检查人员提供培训
• 评估和再评估GMP检查人员能力
• 促进各国家当局和国际组织之间的合作和互联
从以上信息可以清晰地看到,PIC/S的核心是协调统一各个监管机构的检查标准和程序,并确保检查队伍适应的资质和能力等。
04 中国加入PIC/S的趋势
加入PIC/S程序分为预申请和正式申请两个步骤,当申请机构完成本国检查体系与PIC/S要求的差距评估和/或预申请成功后,检查机构可以提出正式加入申请。预加入程序是加入PIC/S的一个步骤,旨在帮助申请者在提出正式申请前更好地理解PIC/S的相关要求。
在今年国家药品监督管理局今年7月表示,国家药监局组织开展了GMP对标评估等工作,通过对标评估,认为中国药品GMP的要求基本等同于欧盟、世界卫生组织药品GMP以及ICH Q7要求。将以加入PIC/S为契机,立足我国国情,进一步完善我国的相关管理规定,统筹协调各省级药品监督管理部门,健全完善我国药品检查体系、稳步提升药品检查能力。
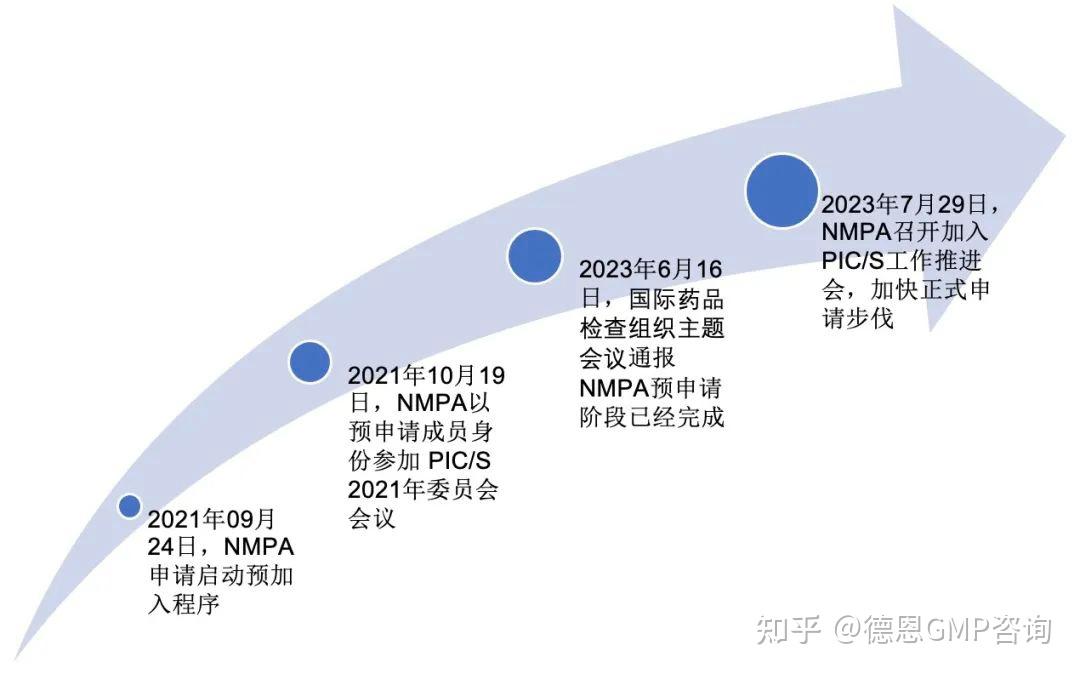
以下是我国申请加入PIC/S的一些关键事项:
图2 申请加入PIC/S的一些关键事件发展
由以上可以看出,我国正在加快优化我们国家的相关管理规定,不断地向PIC/S法规和检查要求靠近,最终提出正式申请成为PIC/S组织一员。
理论上讲,申请机构会在正式提交申请后的18个月可以成为PIC/S成员,从历史数据来看,申请周期可能需要3年~6年,比如美国FDA于2005年正式提交加入申请,历经了6年、2次评估和访问,最终在2011年才得以加入PIC/S。巴西也历经同样长的时间。
05 中国加入PIC/S的意义
整体来说,可以把我国加入PIC/S意义归纳为以下四点:
• 第一,向国际化组织学习更具有可执行性的法规指南和经验。
• 第二,互认性的检查报告,将大大简化产品上市的流程,节省企业成本,加快产品的出口,同时降低监管压力。
• 第三,能提升整个中国医药企业的生产和质量管理水平。
• 第四,对中国整体药监队伍素质的提升也非常重要,尤其是现场核查的监管人员。
总的来说,PIC/S作为药品领域重要的国际组织,通过制订国际通行的药品GMP指南,协调统一各国的药品GMP检查标准,从而促进各国药品监管机构之间的合作互信。加入PIC/S,借鉴国际管理经验,有助于完善我国药品GMP标准,改进我国GMP检查体系,推动药品检查员队伍建设,加强国际检查交流合作,促进我国药品监管事业高质量发展。
对于企业来说,我国在监管要求及监管队伍上会进一步提高已成为必然趋势,企业提前做好规划,以满足医药行业国际化和现代化标准,就显得尤为重要。
文章出处:https://zhuanlan.zhihu.com/p/654201719?utm_id=0